Die Homepage von Joachim Mohr
9.1 Atombau
Demokrit (460-250v.Chr.)...
... ging von kleinsten unteilbaren Atomen aus.J.Dalton(1766-1844)...
... erklärte chemische Verbindungen über Moleküle, die aus Atomen bestehen.L.Bolzmann (19.Jahrhundert...
erzielte mit dem Molekülmodell große Fortschritte.E.Rutherford u.a....
schossen α-Teilchen (Atomkerne eines Helium-4-Atoms mit der Ladung +2e) auf eine Goldfolie. Die meisten α-Teilchen durchdrangen die Goldfolie, aber einige wenige wurde zurückgestreut. Aus weiteren Forschungen weiß man:- Ein Atom besteht aus Atomkern (positiv geladen) und Atomhülle (mit negativ geladenen Elektronen).
- Die Atome des periodischen Systems unterscheiden sich durch die Anzahl Z (Kernladungszahl) der Ladungen im Kern (Protonen) und in der Hülle (Elektronen).
- Atomdurchmesser hat ca. 10-10m, der Kerndurchmesser ca. 10-15m.
- Die Ladungen sind quantisiert (nicht teilbar).
- Der Atomkern besteht aus Z Protonen (posiv geladen) und weiteren Neutronen (ohne Ladung).
- Isotope unterscheiden sich durch die Anzahl der Neutronen.
- Die Masse der Atome besteht aus Vielfachen von der Masseeinheit u (Abweichung unter 0,1u) mit
1 12 u=—— der Massen von C ≈ 1,661*10-27kg. 12 6
Ab 1932 fand man in der Höhenstrahlung und später in Teichenbeschleunigern...
einen Zoo von Elementarteilchen: Pionen, Kaonen, Hyperonen usw. Mehr Ordnung brachte ...1964 Murray Gellmann und Georg Zweig ...
dass jedes Proton aus 3 Quarks besteht, nämlich zwei up-Quarks mit der Ladung +2/3e und einem down-Quark mit der Ladung -1/3e.Das Preoton mit zwei u-Quarks und einem d-Quark besitzt damit die Ladung +e (=2/3e+2/3e-1/3e),
das Neutron mit zwei d-Quarks und einem u-Quark besitzt keine Ladung (-1/3e-1/3e+2/3e).
Lise Meitner und Otto Hahn führtne 1938 und 1939 ...
Versuche durch und enteckten durch Beschuss mit Neutronen die Kernspaltung von Uran.
235 139 95
n+ U → Ba + Kr + 2n + Energie
92 56 36
U=Uran Ba=Barium Kr=Krypton (Edelgas)
Es tritt ein Massedefekt auf, der als Energie wieder autaucht.
E.Fermi baute 1942 die erste Atombombe ...
bei der durch Kettenreaktion große Energien frei werden.9.2 Linienspektum und atomare Übergänge
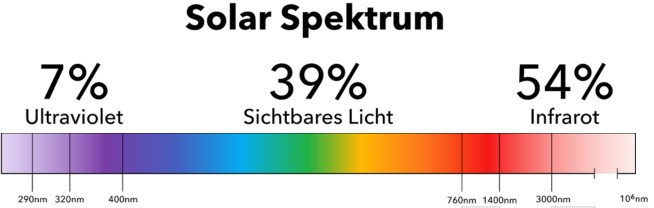 Erhitzte Körper zeigen ein kontinuierliche Spektrum, das v.a. von der Temperatur abhängt.
Erhitzte Körper zeigen ein kontinuierliche Spektrum, das v.a. von der Temperatur abhängt.

Spektrum des Wasserstoffatoms.
Johann Jakom Balmer fand schon 1885 folgende Gesetzmäßigkeit
2
m
λ = λ ·———— für λB=364,56nm. m≥3.
m B 2
m -4
Die ersten Quantenzahlen sind λ3=656nm, λ4=486nm, λ5=434nm, λ6=410nm
Zu Beginn des 20. Jahrhunderts fand man weitere Serein im infraroten und ultravioletten Bereich.
2 2
m ·n
λ = λ ·———————— für λ0=91,2nm für m›n≥1.
m 0 2 2
m - n
Mit f=c/λ errechnen sich die Frequenzen zu
1 1 15
f = f ·(—— - ——) mit f = 3,28984·10 Hz
m,n 0 2 2 0
n m
Die ausgestrahlten Photonen haben dann ganz bestimmte Energien E=h·f.
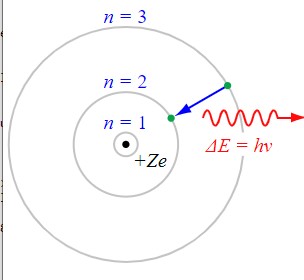
Nach dem Bohrschen Atommodell bewegen sich Elektronen auf Kreisbahnen bestimmter Energie. Hier wechselt ein einzelnes Elektron von der 3. auf die 2. Kreisbahn; es wird ein Photon entsprechender Frequenz ausgesendet.
Die anschauliche Vorstellung von Elektronen, die den Atomkern umkreisen wie Planeten die Sonne, prägt seither das populäre Bild von Atomen. Das Bild von Elektronenbahnen entspricht jedoch nicht den realen Gegebenheiten, es wird in allen quantenmechanischen Atommodellen seit etwa 1925 dadurch ersetzt, dass den Elektronen nur bestimmte Aufenthaltswahrscheinlichkeiten zugesprochen werden. Das Bohrsche Konzept, dass Elektronen sich auf Bahnen bewegen, steht auch im Widerspruch zur Unschärferelation.
Atome können nur solche Photonen absorbieren oder emittieren, deren Energie h·f dem Unterschied zwischen zwei Enegieniveaus des Atoms entspricht entspricht.
9.3 Potentialtopf und Linienspektrum
Das einfachste quantenmechanisches Modell ...
ist der Potentialtopf.Die Wellenfunktion ψ des Elektrons wird klassisch beschrieben. An den Außenwänden (mit unendlich hohen Potential) muss die Wellenfunktion 0 sein.
Die Wellenlänge λ ist also sein: λ=2a, λ=2a/2, λ=2a/3, ..., λ=2a/n (n=1,2,3,...)
Deshalb ist die Energie des Elektrons hier quantisiert.
2 2 2
h h 2 h 2
E = ————, E = ————·2 , E = ————·3 , ...
1 2 2 2 3 2
8ma 8ma 8ma
Das Elektron im Grundzustand mit E1 kann durch Absorption eines Photons angehben werden in einen Energiezustand E2, E3, ...
Atome können nur Photonen mit der Energie h·f = En - Em absorbieren oder emittieren.
Dies ist eine starke Vereinfachung. Die kompliziert berechneten Energieniveaus des Wasserstiffatoms sind:
E1=-13,6eV, E2=-3,372eV, ..., dabei werden die Abstände immer kleiner.
9.4 Stoffe mit Spektren nachweisen
Zum Beispiel Sirius

Charakteristische Linien : H alpha : 6563Å; H beta : 4861Å; H gamma : 4340Å; H delta : 4102Å
(1Å=1Ångström=0,1nm=10-12m)
Er ist etwa doppelt so massereich wie unsere Sonne und etwa 25-mal so hell.
Sirius ist ein A-Typ-Hauptreihenstern, der durch starke Wasserstoff-Balmer-Absorptionslinien und Oberflächentemperaturen zwischen 7600K und 10 000 K gekennzeichnet ist.
Die Balmer-Serie in der Atomphysik ist eine von sechs benannten Serien, die die Spektrallinienemissionen des Wasserstoffatoms beschreiben.
Die Balmer-Serie ist durch den Übergang des Elektrons von n ≥ 3 zu n = 2 gekennzeichnet, wobei n die Hauptquantenzahl des Elektrons bezeichnet.
Sirius enthält also Wasserstoff, der die entsprechenden Wellenlängen absorbiert.
Die wichtigsten Spektralklassen
Spektralklasse Temperatur Beispiel O 28000-50000 B 9900-28000 Regulus ist der hellste Stern im Sternbild Löwe A 7400-9900 Siriua A = hellster Stern am Nachthimmel im Sternbild Hund F 6000-7400 G 4900-6000 Sonne K 3500-4900 M 200-3500 Beteigeuze ist der "Schulterstern" im Sternbild OrionNebenbei bemerkt: Jule Janssen entdecke im Spektrum der Sonne eine Linie mit λ=588nm, eine Spektrallinie, die bisher unbekannt war. Man nannte das Element Helium. Später entdeckte man es auch auf der Erde.